Artigo científico
TRATAMENTO DE LIXIVIADO DE ATERRO SANITÁRIO UTILIZANDO REJEITOS DE CARVÃO
David da Rosa MADRUGA, Fernanda Rosa da SILVEIRA, Silvio Roberto TAFFAREL, Gelsa Edith Navarro HIDALGO, Alexandre KNOP e Rubens Müller KAUTZMANN.
RESUMO
O chorume, lixiviado de aterros sanitários, é um líquido escuro gerado na degradação dos resíduos depositados no aterro. Este efluente possui uma alta carga poluidora, com elevada demanda de oxigênio (DBO e DQO), compostos orgânicos e substancias tóxicas. Com o intuito de prover uma solução alternativa para o tratamento de lixiviados de aterros este trabalho apresenta os resultados iniciais do desenvolvimento de um sistema de tratamento, baseado no uso de rejeitos de carvão (pirita), como catalisador para a etapa de reação química. Para avaliação do processo foram monitorados parâmetros físico-químicos, tais como, DQO, cor, turbidez e sólidos totais do lixiviado antes e depois do processo de tratamento. Foi estudado a influência da concentração de peróxido de hidrogênio, pH e tempo de reação. Foi avaliado também o processo de floculação, após o processo de degradação química. Foram observados uma redução de 99% da turbidez, 98% do percentual de remoção da cor e aproximadamente 76% do percentual de remoção para DQO. Trata-se de um resultado bastante promissor, principalmente levando-se em consideração o caráter poluente do lixiviado e a simplicidade do sistema proposto. Concluiu-se assim que o sistema é eficiente e viável para o tratamento de lixiviado de aterros sanitários.
Palavras-chave: Chorume. Pirita. Tratamento de Efluentes. Processo Fenton. Processo Oxidativo Avançado.
1 INTRODUÇÃO
Ligado ao crescimento populacional e industrial está o problema ambiental causado pela geração de Resíduos Sólidos Urbanos. Uma das formas de tratamento destes resíduos é o aterro sanitário, porém esse processo resulta em um outro problema ambiental, o lixiviado gerado. O lixiviado é o líquido proveniente da decomposição dos resíduos, gerado principalmente pela umidade natural dos resíduos e aumentado nos períodos chuvosos. Normalmente contém altos valores de DBO (Demanda Bioquímica de Oxigênio) e DQO (Demanda Química de Oxigênio) e diversos componentes potencialmente tóxicos, além de carregar materiais dissolvidos ou suspensos que fluem pela massa de lixo após atingir sua capacidade de retenção (ROCHA, 2005). Esse lixiviado pode causar sérios danos ambientais se atingir o lençol freático ou as águas superficiais. Esses danos podem se estender à comunidade animal e vegetal aquática e aos seres humanos que dela se utilizam (LANGE e AMARAL, 2009).
As opções de tratamento para este lixiviado podem ser físico-químicas e biológicas, porém a forma de tratamento que tem tido melhores resultados para o lixiviado são os Processos Oxidativos Avançados (POA). Os processos oxidativos avançados tem como base o uso dos radicais livres reativos que atacam moléculas orgânicas pela abstração de um átomo de hidrogênio ou pela adição às duplas ligações. Esses radicais podem ser obtidos através de agentes oxidantes tais como o ozônio, o peróxido de hidrogênio, além da radiação UV, ou de combinações como O3/H2O2, O3/UV, H2O2/UV, O3/H2O2/UV, e da combinação de peróxido de hidrogênio com íons ferrosos no chamado Processo Fenton (AMORIM et al., 2009 apud AZBAR et al., 2004). A reação Fenton ocorre através da decomposição do peróxido de hidrogênio (H2O2) catalisada por ferro (Fe2+) em meio ácido, gerando assim, radicais hidroxila, elemento fundamental na degradação de moléculas orgânicas resistentes (TEIXEIRA e JARDIM, 2004).
Outro problema ambiental que têm merecido atenção são os resíduos provenientes da mineração do carvão, tal como a pirita. Em exposição com o oxigênio e a água, a pirita produz acidez e oxidação do ferro que quando acelerada pela ação de bactérias do meio, geram ácidos acarretando a dissolução e mobilização de metais, resultando na Drenagem Ácida de Minas (DAM) que é um dos maiores impactos ambientais relacionados à mineração (WEILER, 2016). Uma forma de evitar este problema é a reutilização da pirita, que por ser formada por 46,6% de ferro, pode ser usada como catalisadora no processo Fenton.
Este trabalho teve como objetivo principal avaliar a eficiência do processo Fenton usando a pirita como fonte de ferro, seguido do processo de floculação, no tratamento do lixiviado originado em um aterro sanitário. Foram testados os efeitos dos parâmetros operacionais como dosagens de peróxido e pH, bem como diferentes floculantes e dosagem destes, na etapa de floculação.
2 MATERIAIS E MÉTODOS
2.1. EFLUENTE
O lixiviado utilizado neste trabalho foi coletado no aterro sanitário de resíduos sólidos urbanos, localizado no município de São Leopoldo – RS. O efluente foi coletado no aterro sanitário, acondicionado em bombonas plásticas de 20 litros e transportado para o laboratório do Centro de Estudos Ambientais do Unilasalle, no município de Nova Santa Rita. As amostras foram condicionadas em temperatura de 4°C para posterior analise e tratamento.
2.2 PIRITA
As amostras de pirita utilizadas nos estudos de degradação pelo processo Fenton, foram coletadas diretamente no processo de beneficiamento do carvão, na etapa de lavagem e concentração do carvão. As amostras foram conduzidas ao laboratório, secas em estufa e após foram britadas em britador de mandíbulas. Após a britagem as amostras foram separadas em frações em processo de separação por peneiramento. Para os ensaios foi utilizada a fração com granulometria entre 6# (3350 μm) e 8# (2360 μm) de diâmetro.
2.3 EQUIPAMENTOS
Os reagentes utilizados no processo Fenton foram: peróxido de hidrogênio 50% H2O2 (Breentag Química Brasil). Nos ensaios de floculação foram utilizado FX NS2 (polímero não iônico), FX AS6 (polímero aniônico) e FX CS6 (polímero catiônico) Todos marca Faxon Química, também foram utilizadas soluções de H2SO4 (Synth) e Ca(OH)2 (Neon) para o ajuste de pH do efluente. Todos os reagentes utilizados nas análises possuem grau analítico (P.A.) e as soluções foram preparadas com água deionizada (Milli-Q).
2.4 REAGENTES
Para os ensaios de degradação por processo oxidativo avançado (Fenton) foi utilizado o sistema apresentado no fluxograma da Figura 1. O sistema é composto por um reservatório onde foi colocada a amostra e onde foi feito o ajuste de pH e dosagem de peróxido de hidrogênio. Uma bomba com vazão 1,5 L.min-1 foi utilizada para a circulação do lixiviado pelo sistema de reação, composto por uma coluna de vidro com altura de 50 cm e diâmetro de 9,6 cm, onde as piritas foram colocadas, foram utilizadas mangueiras de silicone para a conexão entre o reservatório e a coluna.
Figura 1 - Sistema de tratamento do chorume. A coluna de vidro com 4,3 kg de pirita conectada por uma mangueira para uma bomba de aquário (1,5L/min de vazão) dentro do balde com 4 L de chorume mais um peagâmetro. Fonte. Autoria própria (2017)
Para realização dos ensaios de floculação foi utilizado um Jar-Teste (EthiK - Modelo 2018-6), as análises de turbidez foram realizadas em um turbidímetro (Digimed - modelo DM-TU), as medições de pH e temperatura foram feitas com um pHgâmetro (HANNA - modelo HI 8424), as análises de cor foram feitas em um calorímetro (Alfakit).
2.5 PROCEDIMENTO ANALÍTICO
As análises do efluente bruto e tratado (após o processo Fenton, e após o processo de Floculação) foram feitas seguindo a metodologia definida pelo Standard Methods for the Examination of Water and Wastewater.
2.6 PROCEDIMENTO DE DEGRADAÇÃO POR PROCESSO FENTON (ETAPA 1)
A amostra do lixiviado bruto acondicionada nas bombonas, foi agitada e colocada em um reservatório com capacidade de 10 L. Foi colocado no reservatório o volume de 4 L do lixiviado. Na sequência foi ajustado o pH e adicionado o peróxido nas condições estabelecidas. Após foi acionada a bomba, para a circulação do lixiviado do reservatório para a coluna com pirita, onde ocorre o processo de degradação. Após a passagem pela coluna o lixiviado foi conduzido novamente para o reservatório, como mostrado na Figura 1. O pH foi monitorado durante o experimento procurando manter o mesmo estável. O experimento teve duração de 90 min. Após o Processo foram feitas coletas e analisados os parâmetros de DQO, cor e turbidez.
3 RESULTADOS E DISCUSSÕES
3.1 CARACTERIZAÇÃO DO LIXIVIADO
O lixiviado foi caracterizado antes e após os tratamentos propostos neste trabalho. A Tabela 1 mostra os resultados das análises físico-químicas realizadas para o lixiviado.
2.7 PROCEDIMENTO DE FLOCULAÇÃO (ETAPA 2)
Após a etapa de degradação pelo processo Fenton, a amostra do lixiviado foi conduzida para a etapa de floculação. A amostra foi misturada e colocada em jarros com capacidade de 1 L. Foram colocados em cada jarro o volume de 500 mL de efluente, e colocado em agitação prévia (120 rpm) por 1 minuto, para homogeneização. Na sequência foi ajustado o pH e adicionado em cada jarro os diferentes floculantes FX AS6 (aniônico), FX NS2 (não-iônico) e FX CS6 (catiônico), na concentração de 400 mg.L-1. Deixou-se sob agitação por 30 segundos com rotação de 120 rpm, em seguida por mais 3min com rotação de 30 rpm. Após o sistema foi desligado e aguardado a decantação do lodo por um período de 30 minutos. Foram coletadas amostras do sobrenadante para as análises de DQO, turbidez, cor e sólidos.
3.2 TRATMENTO OXIDATIVO AVANÇADO (PROCESSO FENTON)
O tratamento do chorume foi realizado sob diferentes condições operacionais para otimizar os parâmetros do processo Fenton sobre a eficiência de remoção de DQO.
3.2.1 Efeito da Concentração de Peróxido
Para determinar o efeito da concentração de peróxido na eficiência de remoção de DQO do lixiviado, a concentração de peróxido foi variada (754 – 2980 mg.L-1), e as outras condições foram fixadas (valor pH inicial de 3,0 e tempo de reação de 90 min). No processo de Fenton, a dosagem de H2O2 é o parâmetro mais importante porque é a fonte de radical HO• e o custo principal para aplicação de aumento de escala.

A Figura 2 mostra que a eficiência de remoção de DQO aumentou significativamente com o aumento da concentração de peróxido de hidrogênio adicionada chegando ao percentual máximo de 84,4% com a concentração de 2234 mg.L-1. Com o aumento da concentração de peróxido para 2980 mg/L não houve uma melhora tendo um percentual de remoção de 50,4%. Essa diminuição na remoção da DQO se deve ao fato de que para maiores concentrações de H2O2, parte do íon Fe2+ catalítico é oxidado a Fe3+ pelo excesso de H2O2, e a capacidade de oxidação do sistema de Fenton diminui. Ainda, concentrações elevadas de H2O2 agem como um consumidor de radical HO• para produzir o radical hidroperoxil (HO2•), que tem uma capacidade de oxidação muito menor do que o radical HO• (Pignatello, 1992; Dutta, et al., 2001; Lee e Shoda, 2008; Jiang, et al., 2010). Assim uma diminuição na eficiência de degradação no processo gerando radicais com menos poder oxidativo.
3.2.2 Efeito do pH do Meio Reacional
Para determinação do parâmetro de pH no processo de oxidação na eficiência de remoção de DQO. As condições foram testadas adicionando peróxido na concentração de 2234 mg.L-1 em um período de 90 min, onde foi testado em pH natural do lixiviado 8,0 e em pH 3,0.
Como se pode observar na figura 3 a condição que teve melhor eficiência no processo foi em pH 3,0 com percentual de remoção de 78,8% de DQO. Já com o pH natural do lixiviado teve uma eficiência de 26,0% de remoção de DQO. Porem para a aplicação industrial, o custo dos reagentes é um dos fatores mais importantes que limitam muitas vezes a aplicação dos POAs. Assim o uso do procedimento em pH 3,0 pode se tornar caro pelo fato de usar reagentes para o ajuste do pH. Porém o lixiviado utilizado neste experimento apresentou um pH de 8,0, neste pH a eficiência do processo Fenton é reduzida, já que em pHs elevados o Fe2+ é convertido a Fe3+, menos efetivo na geração do radica hidroxila.
Entretanto podemos observar em pH natural (8,0) foi obtido um percentual de remoção de DQO de 26,0%. Conforme Wang et al. (2008), para valores de pH superiores a 4, os íons ferrosos facilmente se convertem a íons férricos que, na presença de hidróxido, produzem os complexos hidróxido-férricos, capazes de coagular e precipitar não só a matéria orgânica como também outros sólidos remanescentes após a oxidação por Fenton.
3.3 TRATAMENTO FÍSICO-QUÍMICO (FLOCULAÇÃO)
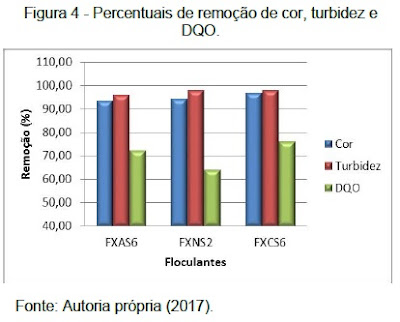
O tratamento do lixiviado através do processo de floculação após o processo oxidativo (Fenton), foi realizado aplicando diferentes floculantes para definir o mais eficaz na remoção de DQO, cor e turbidez. A Figura 4 mostra os resultados obtidos nos ensaios de jar-test.
Amostras do chorume tratado após 15, 30, 60 e 90 minutos
Como pode ser observado, com relação ao parâmetro de turbidez, os três coagulantes testados apresentaram uma eficiência em torno de 97,3%, sendo efetivos na remoção de material particulado em suspensão. Com relação ao parâmetro cor o floculante FXCS6 teve uma eficiência de 96,8% onde apresenta o melhor resultado, sendo que para o FXAS6 e FXNS2 a eficiência de remoção foi de 93,6% e 94,3% tendo também bons resultados. Para o parâmetro de DQO os Floculantes testados apresentaram resultados de 73,0% e 64,2% nos floculantes FXAS6 e FXNS2 respectivamente, sendo o melhor resultado de 75,9% de remoção com o floculante FXCS6.
Como pode ser observado na Figura 4 podemos afirmar que os melhores resultados para as análises de cor, turbidez e DQO foram obtidas utilizando o floculante catiônico FX CS6. Por obter cargas positivas, os polímeros catiônicos se ligam mais facilmente as cargas negativas contidas nas substâncias orgânicas, obtendo-se então maior eficiência no processo de floculação do que os floculantes aniônicos (cargas negativas) e não iônico (neutro).
4 CONCLUSÕES
O processo de tratamento de um lixiviado, proposto neste trabalho, composto de uma etapa prévia pelo tratamento por processo fenton, seguida pelo processo de floculação. Obteve um percentual de remoção de 84,4% de remoção para os parâmetros do DQO com a concentração de 2234 mg/L em pH 3,0. No Processo de floculação os melhores resultados foram obtidos com o floculante catiônico FX CS6 tendo um percentual de remoção de 96,8%, 97,9% 75,9% de cor, turbidez e DQO respectivamente. A utilização da pirita como fonte de ferro mostrou grande eficácia como fonte catalítica de reação no processo Fenton. Obtendo-se então estes resultados, pode-se concluir que a reação Fenton utilizando-se peróxido de hidrogênio como agente oxidante e a pirita como fonte de ferro catalítico pode ser utilizado como parte do tratamento de lixiviados de aterro sanitário, com grande eficácia.
5 REFERÊNCIAS
AMORIM, C. C.; LEÃO, M. M. D.; MOREIRA, R. F. P. M. Comparação entre diferentes processos oxidativos avançados para degradação de corante azo. Eng Sanit Ambient. v.14 n.4. out/dez 2009.
DUTTA, K.; MUKHOPADHYAY, S.; BHATTACHARJEE, S.; CHAUDHURI, B. Chemical oxidation of methylene blue using a Fenton-like reaction, J. Hazard. Mater. v. 84, p. 57–71, 2001.
JIANG, J.Y.; LI, Y.; WANG, G.W.; ZHOU, Y.X. Treatment of acrylic fiber polymerization wastewater by Fenton method, Res. Environ. Sci. (China) v. 23, 897–901, 2010.
LANGE, L. C.; AMARAL, M. C. S. Geração e características do lixiviado. In: GOMES, L. P. (Coord.). Estudos de caracterização e tratabilidade de lixiviados de aterros sanitários para as condições brasileiras. São Leopoldo: ABES, 2009. p. 26-59.
LEE, H.; SHODA M.; Removal of COD and color from livestock wastewater by the Fenton method, J. Hazard. Mater. v. 153, 1314–1319, 2008.
ROCHA, E. M. R. Desempenho de um sistema de lagoas de estabilização na redução da carga orgânica do percolado gerado no aterro da Muribeca . PE. 2005. 151f. Dissertação (Mestrado em Engenharia Civil) – Universidade Federal de Pernambuco, Recife. 2005.
TEIXEIRA, C. P. A. B.; JARDIM, W. F. Processos Oxidativos Avançados, Conceitos teóricos. Universidade Estadual de Campinas-UNICAMP. Campinas,SP, v.3, 2004.
WEILER, J. Benefícios ambientais da recuperação da pirita na mineração de carvão em SC. Dissertação ( Mestrado em Endenharia). Universidade Federal Do Rio Grande Do Sul. Porto Alegre. 2016.
PIGNATELLO, J. J., Dark and photoassisted iron (3+)-catalyzed degradation of chlorophenoxy herbicides by hydrogen peroxide, Environ. Sci. Technol. v. 26, p. 944–951, 1992.